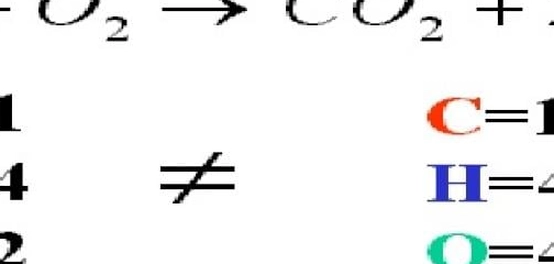محتويات
- المعادلة المتوازنة: أساس فهم التفاعلات الكيميائية
- موازنة المعادلات الكيميائية: ضمان توازن العناصر
- موازنة معادلات الأكسدة والاختزال: تحدٍ جديد
- المراجع
المعادلة المتوازنة: أساس فهم التفاعلات الكيميائية
تُعد المعادلة المتوازنة معادلة كيميائية تُستخدم لوصف تفاعل كيميائي دقيق، حيث تُظهر عدد الذرات لكل عنصر في المواد المتفاعلة والمواد الناتجة بشكل متساوٍ، بما في ذلك الشحنة الكلية. بمعنى آخر، تُحافظ المعادلة المتوازنة على قانون حفظ الكتلة، الذي ينص على أنه لا يمكن إزالة المادة أو خلقها في التفاعلات الكيميائية، بل يتم إعادة ترتيب الذرات فقط.
موازنة المعادلات الكيميائية: ضمان توازن العناصر
لضمان دقة وصف تفاعل كيميائي، يجب أن تكون معادلة التفاعل متوازنة. هذا يعني أن عدد ذرات كل عنصر في المواد المتفاعلة يجب أن يساوي عدد ذرات ذلك العنصر في المواد الناتجة.
على سبيل المثال، عند تفاعل ذرتي الهيدروجين مع ذرة الأكسجين (O2) ، ينتج الماء (H2O) .
خلال هذا التفاعل، تتكسر الروابط بين ذرتي الأكسجين في جزيء الأكسجين O-O ، وكذلك الروابط بين ذرتي الهيدروجين H-H ، لتكوين روابط جديدة بين الهيدروجين والأكسجين H-O .
لضمان موازنة المعادلة، نحتاج إلى استخدام معاملات (أرقام أمام الصيغ الكيميائية) لضبط عدد ذرات كل عنصر على جانبي المعادلة:
2H2 + O2 → 2H2O
تُشير المعاملات في المعادلة المتوازنة إلى عدد جزيئات كل مادة مشاركة في التفاعل. إذا لم يكن هناك رقم أمام صيغة مادة معينة، فهذا يعني أن معاملها يساوي 1.
موازنة معادلات الأكسدة والاختزال: تحدٍ جديد
تُعد موازنة معادلات الأكسدة والاختزال أكثر تعقيدًا من موازنة المعادلات العادية، حيث تُتضمن إلكترونات تُنتقل بين المواد المتفاعلة والمواد الناتجة. ومع ذلك، تُطبق نفس مبادئ الحفاظ على الكتلة والشحنة، وتستخدم طريقة “أنصاف المعادلات” لموازنة هذه المعادلات.
تُقسم معادلة الأكسدة والاختزال إلى نصفين: نصف للأكسدة ونصف للاختزال. ثم تُوازَن كل نصف معادلة بشكل منفصل وفقًا للخطوات التالية:
- موازنة عناصر المعادلة باستثناء الهيدروجين (H) والأكسجين (O) .
- موازنة ذرات الأكسجين بإضافة جزيئات الماء (H2O) إلى الطرف المقابل من المعادلة.
- موازنة ذرات الهيدروجين بإضافة أيونات الهيدروجين (H+) إلى الطرف الآخر من المعادلة.
- موازنة الشحنات بين الطرفين بإضافة إلكترونات (e–) إلى الطرف الموجب.
- التأكد من تساوي عدد الإلكترونات على طرفي المعادلة.
- جمع أنصاف المعادلات معًا مع حذف الإلكترونات والعناصر المشتركة بين طرفي المعادلة لإنتاج معادلة متوازنة.
- ملاحظة: في حال تمت موازنة المعادلة في الوسط القاعدي، يجب إضافة عدد مناسب من أيونات الهيدروكسيد (OH–) إلى المعادلة لإعادة أيونات الهيدروجين (H+) إلى جزيئات الماء.
المراجع
- Anne Marie Helmenstine, “Balanced Equation Definition”, www.thoughtco.com, Retrieved 14-4-2018. Edited.
- ANTHONY CARPI, “Balancing equations”, www.visionlearning.com, Retrieved 8-4-2018. Edited.
- Ann Nguyen, Luvleen Brar, “Balancing Redox Reactions”, chem.libretexts.org, Retrieved 14-4-2018. Edited.