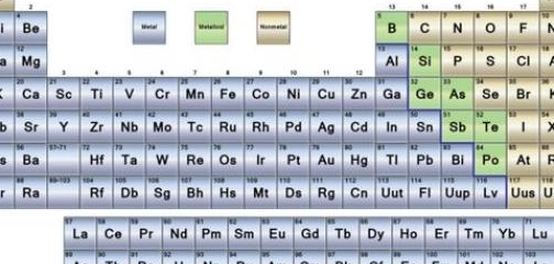
نبذة عن الجدول الدوري
الجدول الدوري للعناصر، أو ما يعرف بجدول مندليف، هو تمثيل مرئي للعناصر الكيميائية المعروفة، مرتبة وفقًا لخصائصها الذرية والكيميائية. يرجع الفضل في وضع الأسس لهذا الجدول إلى العالم الروسي ديمتري مندليف، الذي قام بتطويره بين عامي 1869 و1870. اعتمد مندليف في تصنيفه على حسابات دقيقة لكتل العناصر وخصائصها الدورية، ورتبها بناءً على ذلك. بمرور الوقت، تم إضافة المزيد من العناصر المكتشفة حديثًا إلى الجدول، حتى وصل إلى شكله الحالي.
آلية تنظيم العناصر في الجدول الدوري
يتضمن الجدول الدوري الحديث 118 عنصرًا، مرتبة في 18 مجموعة رأسية. تعتمد هذه الترتيبات على التشابه في الخصائص الكيميائية للعناصر. يمكن تقسيم العناصر في الجدول الدوري إلى عدة أنواع رئيسية، ولكل نوع خصائص مميزة:
أنماط العناصر المكونة للجدول الدوري
- العناصر النبيلة (الغازات النبيلة): هي عناصر ذات مدارات خارجية مكتملة بالإلكترونات، مما يجعلها غير نشطة كيميائيًا.
- العناصر الممثلة (العناصر المثالية): هي العناصر التي تمتلئ جميع مداراتها باستثناء المدار الأخير.
- العناصر الانتقالية الرئيسية: هي العناصر التي تفتقر إلى عدد من الإلكترونات في المستويين الخارجيين.
- العناصر الانتقالية الداخلية: هي العناصر التي تفتقر إلى عدد من الإلكترونات في المدارات الثلاثة الخارجية.
اتجاهات تغير الخواص في الجدول الدوري
تظهر العديد من الخصائص الذرية للعناصر اتجاهات دورية واضحة عبر الجدول الدوري، مما يعني أنها تتغير بطريقة منتظمة عند الانتقال من اليسار إلى اليمين عبر الدورة، أو من الأعلى إلى الأسفل عبر المجموعة. من بين هذه الخصائص: نصف قطر الذرة، وطاقة التأين.
تغيرات نصف قطر الذرة في الجدول الدوري
يعرف نصف قطر الذرة بأنه المسافة بين نواتي ذرتين متجاورتين في الجزيء (في حالة الروابط التساهمية)، أو المسافة بين أيونيْن متجاورين في المركب الأيوني (في حالة الروابط الأيونية). يتغير نصف قطر الذرة في الجدول الدوري على النحو التالي:
- في الدورة الواحدة، يقل نصف قطر الذرة بزيادة العدد الذري (أي بالاتجاه من اليسار إلى اليمين). يعزى ذلك إلى زيادة الشحنة الموجبة للنواة، مما يزيد من قوة جذبها للإلكترونات، وبالتالي يقلص حجم الذرة.
- في المجموعة الرأسية، يزداد نصف قطر الذرة بزيادة العدد الذري (أي بالاتجاه من الأعلى إلى الأسفل). يعزى ذلك إلى زيادة عدد مستويات الطاقة في الذرة، مما يزيد من حجب تأثير النواة على الإلكترونات الخارجية، وبالتالي يقل التجاذب بينها وتزداد قوة التنافر.
- نصف قطر الأيون الموجب أصغر من نصف قطر الذرة المتعادلة في الفلزات، لأن الشحنة الموجبة للنواة تجذب الإلكترونات نحوها، مما يقلل من نصف القطر.
- نصف قطر الأيون السالب أكبر من نصف قطر الذرة المتعادلة في اللافلزات؛ لأن الشحنة السالبة للإلكترونات تزيد من قوة التنافر في الأيون.
تغيرات طاقة التأين في الجدول الدوري
طاقة التأين هي الطاقة اللازمة لإزالة أقل الإلكترونات ارتباطًا بالذرة. تتغير طاقة التأين بتغير موقع العنصر في الجدول الدوري:
- يزداد جهد التأيّن في الدورة الواحدة بزيادة العدد الذري، بسبب زيادة الشحنة الموجبة التي تزيد من ارتباط الإلكترونات في الذرة.
- يقلّ جهد التأيّن في المجموعة الرأسية بزيادة العدد الذري، بسبب زيادة مستويات الطاقة التي تحجب قوّة جذب النواة.
- جهد التأين الأول للغازات الخاملة كبير جداً، أي أنّ الطاقة اللازمة لإزالة أول إلكترون من مداراتها كبيرة بسبب اكتمال المدارات واستقرارها.
- جهد التأين الثاني لأي عنصر أكبر من جهد التأين الأول له، بسبب زيادة قوة جذب النواة، بالإضافة إلى أنّ إزالة إلكترون ثانٍ قد تتسبب في كسر مستوى طاقة.
قال تعالى: “قُلْ هَلْ يَسْتَوِي الَّذِينَ يَعْلَمُونَ وَالَّذِينَ لَا يَعْلَمُونَ ۗ إِنَّمَا يَتَذَكَّرُ أُولُو الْأَلْبَابِ” (الزمر: 9).
قال رسول الله صلى الله عليه وسلم: “مَنْ سَلَكَ طَرِيقًا يَلْتَمِسُ فِيهِ عِلْمًا، سَهَّلَ اللَّهُ لَهُ طَرِيقًا إِلَى الْجَنَّةِ”.