مقدمة حول الرقم الكتلي
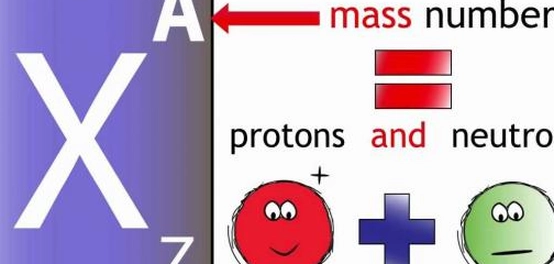
الرقم الكتلي يمثل المجموع الكلي لعدد البروتونات والنيوترونات الموجودة في نواة ذرة عنصر ما. يُرمز له بالحرف (A). يمكن اعتبار الرقم الكتلي لأي ذرة مساوياً للكتلة الذرية مقربة لأقرب عدد صحيح. يستخدم الرقم الكتلي في تنظيم جدول النظائر. اكتشف العلماء ذرات تتفق في العدد الذري ولكنها تختلف في الرقم الكتلي، وأطلقوا عليها اسم النظائر. أمثلة على ذلك: 168O ،178O، 188O. عند تمثيل عنصر مع العدد الذري والكتلي، يُكتب العدد الذري أسفل يسار رمز العنصر، بينما يُكتب الرقم الكتلي أعلى يسار رمز العنصر (AZX). على سبيل المثال، النيتروجين برقمه الكتلي 14 وعدد بروتوناته 7، يُكتب كالتالي: (147N).
يوجد فرق بين مفهومي العدد الذري والرقم الكتلي. العدد الذري يعبر عن عدد البروتونات في الذرة، ويرمز له بالرمز (Z). تكمن أهميته في تحديد هوية العنصر وخصائصه الكيميائية، لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المتعادلة. عدد البروتونات ثابت للعنصر الواحد ولا يتغير. إذا تغير العدد الذري، يتغير العنصر نفسه. مثال: ذرات الأكسجين تحتوي على 8 بروتونات، وبالتالي فالعدد الذري للأكسجين هو 8، وفي حال تغيّر هذا العدد فإنّ الذرة لا تكون ذرة أكسجين.[٣]
طريقة حساب الرقم الكتلي
يمكن حساب الرقم الكتلي لأي عنصر باستخدام المعادلة التالية:
الرقم الكتلي = عدد البروتونات + عدد النيوترونات
لا تدخل كتلة الإلكترونات في حساب الرقم الكتلي بسبب صغرها الشديد. يمكن معرفة عدد النيوترونات عن طريق طرح العدد الذري من الرقم الكتلي:
عدد النيوترونات = الرقم الكتلي – العدد الذري
التمييز بين الرقم الكتلي والكتلة الذرية
هناك اختلاف بين الرقم الكتلي والكتلة الذرية. الرقم الكتلي يعبر عن عدد البروتونات والنيوترونات في نواة العنصر، بينما الكتلة الذرية تعبر عن متوسط كتلة البروتونات والنيوترونات لنظائر العنصر الموجودة في الطبيعة. الرقم الكتلي دائماً عدد صحيح، لأنه يمثل إجمالي عدد البروتونات والنيوترونات. الكتلة الذرية ليست بالضرورة عدداً صحيحاً، بل تكون أعداداً عشرية، وتعبر عن الكتلة الدقيقة للذرة. يتم التعبير عن الكتلة الذرية بوحدة كتلة ذرية (amu)، حيث تمثل وحدة الكتلة الذرية الواحدة 1/12 من كتلة ذرة الكربون-12 (12C)، أي أن الكتلة الذرية بالغرام تساوي (1.66× 10-24).
على سبيل المثال، ذرة الكربون-12 تحتوي على 6 نيوترونات، وكتلتها الذرية تساوي 12 وحدة كتلة ذرية. لا يوجد نظير آخر له كتلة صحيحة غير الكربون-12.[٤]
يمكن اعتبار الكتلة الذرية مطابقة حسابياً للرقم الكتلي للعنصر مع بعض الاختلافات في المنازل العشرية. هذا الاختلاف يعود إلى أن البروتونات والنيوترونات لا تزن وحدة كتلة ذرية واحدة (amu). البروتون يزن 1.0072765 وحدة كتلة ذرية، والنيوترون يزن 1.0086650 وحدة كتلة ذرية. أيضاً، البروتونات والنيوترونات مرتبطة في النواة الذرية، مما يجعل كتلة النواة أقل من المجموع الكتلي للبروتونات والنيوترونات فيها.[٩]
أمثلة توضيحية
مثال 1:
إذا كان عدد البروتونات في ذرة الهيليوم (He) هو 2، وعدد النيوترونات هو 2، فما هو الرقم الكتلي للهيليوم؟[٣]
الحل:
الرقم الكتلي = عدد البروتونات + عدد النيوترونات
الرقم الكتلي = 2 + 2 = 4
مثال 2:
ما هو الرقم الكتلي لعنصر الليثيوم (Li)، إذا كان عدد البروتونات فيه 3 وعدد النيوترونات 4؟[٣]
الحل:
الرقم الكتلي = عدد البروتونات + عدد النيوترونات
الرقم الكتلي = 3 + 4 = 7
مثال 3:
ما هو عدد النيوترونات في ذرة الكروم (Cr)، التي عددها الذري 24 ورقمها الكتلي 52؟[٣]
الحل:
عدد النيوترونات = الرقم الكتلي – العدد الذري
عدد النيوترونات = 52 – 24 = 28 نيوترونًا
مثال 4:
ذرة عددها الكتلي 32 وعددها الذري 16، فما هو عدد النيوترونات فيها؟[٦]
الحل:
بما أن العدد الذري يساوي عدد البروتونات، والرقم الكتلي= عدد البروتونات + عدد النيوترونات، فإن 32= 16 + عدد النيوترونات، وبالتالي فإن عدد النيوترونات= 32 – 16 = 16 نيوتروناً.
مثال 5:
ذرة عددها الذري 11، وعدد النيوترونات فيها 12، فما هو العدد الكتلي لها؟[٦]
الحل:
بما أن العدد الذري يساوي عدد البروتونات، فإن عدد البروتونات يساوي 11، إذن العدد الكتلي= عدد البروتونات + عدد النيوترونات، وبالتالي العدد الكتلي= 11 + 12 = 23.
مثال 6:
ذرة عددها الذري 9 وعددها الكتلي 19، فما هو عدد البروتونات، وعدد الإلكترونات، وعدد النيوترونات فيها؟[٧]
الحل:
عدد البروتونات هو 9؛ لأن عدد البروتونات يساوي دائماً العدد الذري.
عدد الإلكترونات هو 9؛ وذلك لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المتعادلة.
عدد النيوترونات هو 10؛ وذلك لأن عدد النيوترونات يمكن الحصول عليه من خلال طرح العدد الذري من العدد الكتلي، أي أن (عدد البروتونات + عدد النيوترونات) – (عدد البروتونات) = عدد النيوترونات.