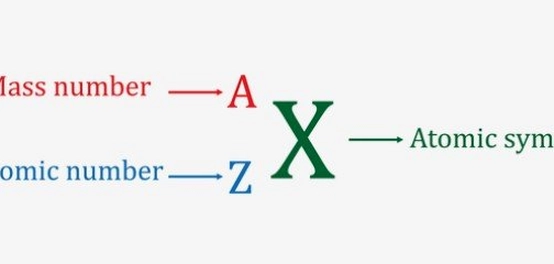ما هو الرقم الذري؟
الرقم الذري، الذي يُرمز له بالرمز (Z)، يمثل عدد البروتونات الموجودة في نواة الذرة. هذا الرقم هو المحدد الرئيسي لنوع العنصر وخصائصه الفريدة. فهو بمثابة بصمة فريدة تحدد هوية العنصر وتميزه عن غيره.
جدير بالذكر أن الجدول الدوري الحديث للعناصر، وهو مخطط أساسي في علم الكيمياء، يعتمد في ترتيبه على الزيادة التدريجية في الرقم الذري للعناصر. هذا الاكتشاف يعود للعالم هنري موزلي. يظهر الرقم الذري عادةً أعلى رمز العنصر في الجدول الدوري. وعند كتابة رمز العنصر، يُكتب الرقم الذري كرقم صغير على يسار العنصر من الأسفل.
ما هو الوزن الذري؟
يُعرف الوزن الذري (أو الرقم الكتلي)، ويرمز له بالرمز (A)، بأنه مجموع عدد البروتونات والنيوترونات الموجودة في نواة الذرة. يمكن حسابه باستخدام المعادلة التالية:
الوزن الذري = عدد البروتونات + عدد النيوترونات
في الجدول الدوري، يظهر الوزن الذري أسفل رمز العنصر. وعند تمثيل العنصر، يُكتب الوزن الذري كرقم صغير على يسار العنصر من الأعلى.
من المهم الإشارة إلى أن كتلة الإلكترونات لا تؤخذ في الاعتبار عند حساب الوزن الذري، لأنها صغيرة جدًا، وتعتبر أقل بحوالي 1800 مرة من كتلة البروتون. بالإضافة إلى ذلك، فإن الوزن الذري لأي ذرة يساوي تقريبًا الكتلة الذرية مقربةً إلى أقرب عدد صحيح. تجدر الإشارة أيضا الى أن النظائر المختلفة لنفس العنصر تمتلك أوزاناً ذرية مختلفة نتيجة لاحتوائها على أعداد مختلفة من النيوترونات.
كيف يؤثر الرقم الذري على الخصائص الكيميائية للعنصر؟
يمكن تحديد الخصائص الكيميائية للعنصر من خلال معرفة رقمه الذري وموقعه في الجدول الدوري، وذلك لأن عدد البروتونات في الذرة المتعادلة كهربائياً يساوي عدد الإلكترونات.
من خلال معرفة عدد الإلكترونات، يمكن تحديد التوزيع الإلكتروني للعنصر، وبالتالي معرفة طبيعة إلكترونات التكافؤ الموجودة في المدار الأخير. هذه الإلكترونات تحدد قدرة الذرة على المشاركة بالإلكترونات وتكوين روابط كيميائية أثناء التفاعلات المختلفة.
أمثلة توضيحية لحساب الرقم الذري والوزن الذري
يستخدم الرقم الذري والوزن الذري لتكوين فهم شامل للذرة والعناصر، بما في ذلك خصائصها وصفاتها، وقوة ارتباط النواة بالذرات، وعدد البروتونات والإلكترونات والنيوترونات لكل عنصر. فيما يلي بعض الأمثلة التوضيحية:
مثال (1):
ذرة لديها رقم ذري 9، ووزن ذري 19. ما هو عدد البروتونات والإلكترونات والنيوترونات فيها؟
الحل:
- عدد البروتونات هو 9، لأن عدد البروتونات دائمًا يساوي الرقم الذري.
- عدد الإلكترونات هو 9، لأن عدد البروتونات يساوي عدد الإلكترونات في الذرة المتعادلة.
- عدد النيوترونات هو 10، ويمكن الحصول عليه عن طريق طرح الرقم الذري من الوزن الذري: (عدد البروتونات + عدد النيوترونات) – (عدد البروتونات) = عدد النيوترونات.
مثال (2):
ما هو عدد النيوترونات في ذرة الكلور (Cl) التي رقمها الذري 17، ووزنها الذري 35؟
الحل:
بما أن الرقم الذري يساوي عدد البروتونات، والوزن الذري = عدد البروتونات + عدد النيوترونات،
فإن 35 = 17 + عدد النيوترونات
وبالتالي فإن عدد النيوترونات = 35 – 17 = 18 نيوترونًا.
مثال (3):
ذرة الصوديوم (Na)، رقمها الذري هو 11، ما هو عدد البروتونات والإلكترونات؟
الحل:
نلاحظ أن الرقم الذري = عدد البروتونات = عدد الإلكترونات في الذرة المتعادلة. بالتالي، فإن عدد البروتونات يساوي 11، وعدد الإلكترونات يساوي 11 أيضًا.
مثال (4):
ما هو عدد البروتونات والنيوترونات والإلكترونات في الذرة المتعادلة لعنصري البورون (10B5) والزئبق (199Hg80)؟
الحل:
- العدد الذري في ذرة البورون = 5، إذاً عدد البروتونات = 5، وعدد الإلكترونات = 5، وعدد النيوترونات = 5.
- العدد الذري في ذرة الزئبق = 80، إذاً عدد البروتونات = 80، عدد الإلكترونات = 80، وعدد النيوترونات = 119.
الرقم الذري والوزن الذري لبعض العناصر الشائعة
يعرض الجدول التالي الأرقام الذرية والكتلية لبعض العناصر الأكثر استخدامًا، مرتبة من المجموعة الأولى إلى المجموعة الثامنة:
| رقم المجموعة | العنصر | الرقم الذري | الوزن الذري | العنصر | الرقم الذري | الوزن الذري | العنصر | الرقم الذري | الوزن الذري |
|---|---|---|---|---|---|---|---|---|---|
| 1 | الهيدروجين (H) | 1 | 1 | الليثيوم (Li) | 3 | 6 | الصوديوم (Na) | 11 | 23 |
| 2 | البريليوم (Be) | 4 | 10 | المغنيسيوم (Mg) | 12 | 24 | الكالسيوم (Ca) | 20 | 40 |
| 3 | البورون (B) | 5 | 11 | الألمنيوم (Al) | 13 | 27 | الجاليوم (Ga) | 31 | 70 |
| 4 | الكربون (C) | 6 | 12 | السيليكون (Si) | 14 | 28 | الرصاص (Pb) | 82 | 207 |
| 5 | النيتروجين (N) | 7 | 14 | الفسفور (P) | 15 | 31 | الزرنيخ (As) | 33 | 75 |
| 6 | الأكسجين (O) | 8 | 16 | الكبريت (S) | 16 | 32 | البولونيوم (Po) | 84 | 206 |
| 7 | الفلور (F) | 9 | 19 | الكلور (Cl) | 17 | 35.5 | البروم (Br) | 35 | 80 |
| 8 | الهيليوم (He) | 2 | 4 | النيون (Ne) | 10 | 20 | الأرغون (Ar) | 18 | 40 |