مقدمة عامة عن المادة
في الفيزياء والكيمياء، تُعرف المادة بأنها أي شيء يشغل حيزًا وله كتلة. إنها العنصر الأساسي الذي يتكون منه الكون. تتألف المادة من الذرات، التي بدورها تتكون من ثلاثة أنواع من الجسيمات: البروتونات والنيوترونات والإلكترونات. تتحد الذرات لتشكيل الجزيئات، وهي اللبنات الأساسية لجميع المواد. تحمل الذرات والجزيئات طاقة كامنة تسمى الطاقة الكيميائية.
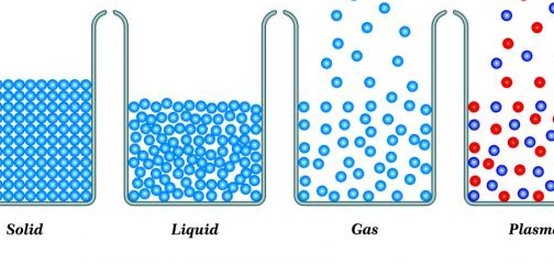
توجد المادة في ثلاث حالات أساسية على الأرض، وقد حددها الإغريق القدماء بناءً على ملاحظاتهم للماء. هذه الحالات هي: الصلبة والسائلة والغازية. بالإضافة إلى ذلك، اكتشف العلم لاحقًا حالة رابعة للمادة تسمى البلازما، وهي تتكون من جسيمات مشحونة ذات طاقة حركية عالية جدًا. على الرغم من أن البلازما قد لا تكون شائعة على الأرض، إلا أنها أكثر حالات المادة شيوعًا في الكون، فالنجوم تتكون أساسًا من بلازما شديدة الحرارة.
خصائص الحالة الصلبة
الحالة الصلبة هي إحدى الحالات الثلاث للمادة، وتتميز بأن قوى التجاذب بين جزيئاتها أكبر من قوى التنافر. هذا يجعل الجزيئات ثابتة في مكانها وقريبة جدًا من بعضها البعض. ومع ذلك، فإن ذرات وجزيئات المادة الصلبة لا تزال في حركة مستمرة بسبب الطاقة الاهتزازية التي تمتلكها. تزداد كمية الاهتزاز مع زيادة درجة حرارة المادة الصلبة.
تتميز المواد الصلبة بخصائص تميزها عن الحالات الأخرى، مثل الشكل الثابت والمحدد. لا تغير المواد الصلبة شكلها بتغير شكل الوعاء الذي توضع فيه، ولكن يمكن أن يتغير شكلها عند تعرضها لقوة كافية لكسرها. كما تتميز المواد الصلبة بكتلة وحجم ثابتين، بالإضافة إلى كثافة عالية بسبب تقارب جزيئاتها. في العديد من المواد الصلبة، تنتظم الجزيئات والذرات والأيونات في نمط منتظم ومتكرر على شكل شبكة بلورية. من الأمثلة على المواد الصلبة البلورية ملح الطعام والسكر والألماس. قد تمتلك المادة الواحدة أكثر من هيكل بلوري في بنيتها.
وصف الحالة السائلة
تتحول المادة من الحالة الصلبة إلى الحالة السائلة عندما تزداد الطاقة الداخلية للمادة، عادةً عن طريق زيادة درجة الحرارة، إلى الحد الذي يسمح بتفكيك الروابط بين جزيئات المادة الصلبة. في الحالة السائلة، تظل الجزيئات قريبة نسبيًا من بعضها البعض، ولكنها تمتلك طاقة حركية تسمح لها بالابتعاد عن بعضها البعض، مما يزيد من فرص اصطدامها معًا. تزداد الحركة كلما زادت درجة حرارة السائل. ومع ذلك، فإن هذه الجزيئات لا تزال مرتبطة بقوى بين جزيئية ضعيفة مثل الروابط الهيدروجينية، التي تحاول الحفاظ على بقاء الجزيئات قريبة من بعضها. تتميز المادة في الحالة السائلة بخصائص مثل القدرة على تغيير شكلها وفقًا لشكل الوعاء الذي توضع فيه، مما يعني أنها ذات شكل غير ثابت، ولكنها ذات حجم ثابت وغير قابلة للانضغاط بسهولة بسبب تقارب الجزيئات فيها.
استعراض الحالة الغازية
تنتقل المادة إلى الحالة الغازية عندما تزداد الطاقة الداخلية بشكل كبير، متجاوزة قوى التجاذب بين الجزيئات. يصبح تفاعل جزيئات المادة مع بعضها في أدنى مستوياته، وتتحرك الجزيئات بحرية وبسرعة كبيرة في جميع الاتجاهات ولمسافات طويلة. تزداد الطاقة الحركية للجزيئات مع زيادة درجة الحرارة.
تتميز الغازات بعدة خصائص، منها عدم وجود شكل أو حجم محدد. تتخذ الغازات شكل الوعاء الذي توضع فيه وتتمدد بحسب سعته. عند عدم حصرها في وعاء معين، تتباعد جزيئات الغاز وتنتشر بشكل واسع. كما تتميز الغازات بكثافة منخفضة نظرًا لتباعد جزيئاتها الكبير، وقابليتها للانضغاط بسهولة بسبب انعدام قوى الترابط بين الجزيئات أو وجودها بشكل ضعيف. يمكن زيادة الضغط على الغاز بتقليل حجم الوعاء المحصور فيه، مما يؤدي إلى تقليل المسافة بين الجزيئات.
تتشابه المادة في حالتيها الغازية والسائلة في أنها تعتبر موائع، أي أنها قابلة للجريان والسيلان على سطح جسم ما. تتحرك الجزيئات في الموائع بشكل عشوائي ومستمر، وتتصادم مع بعضها البعض ومع جدران الوعاء الموضوع فيه.
مقارنة بين الحالات المختلفة مع أمثلة
يوضح الجدول التالي أهم الفروقات الرئيسية بين حالات المادة الثلاث:
| الخاصية | الحالة الصلبة | الحالة السائلة | الحالة الغازية |
|---|---|---|---|
| الشكل | شكل ثابت | شكل متغير | شكل متغير |
| الحجم | حجم ثابت | حجم ثابت | حجم متغير |
| القابلية للانضغاط | لا يمكن ضغطها بسهولة | لا يمكن ضغطها بسهولة | يمكن ضغطها بسهولة |
| الكثافة | كثافة عالية أو عالية جداً | كثافة عالية | كثافة منخفضة جداً |
| قوى التجاذب بين الجزيئات | قوية جداً | أقلّ من القوى بين جزيئات المادة الصلبة، وأكبر من القوى بين جزيئات المادة الغازية | تكاد تكون معدومة |
| المسافة بين الجزيئات | لا يوجد مسافة بين الجزيئات | متوسّطة | كبيرة جداً وممتدة |
من أشهر الأمثلة على المواد الصلبة الخشب والمعادن والحجر. أما المواد الغازية فمن أشهر الأمثلة عليها الهواء المحيط بنا والأكسجين والهيليوم. في حين يعد الماء والزيت أمثلة على السوائل، إلى جانب الزئبق الذي يشكل حالة فريدة بين السوائل، فهو المعدن الوحيد الذي يوجد في الحالة السائلة في درجة حرارة الغرفة العادية.
آلية التحول بين حالات المادة
تتميز المادة بقدرتها على الانتقال والتحول من حالة لأخرى. يمكن أن تنتقل من الحالة السائلة إلى الغازية، أو من الحالة الصلبة إلى السائلة، وغير ذلك من الاحتمالات. على سبيل المثال، يوجد الماء في الحالة السائلة في الظروف ودرجات الحرارة الطبيعية، ولكنه يتحول إلى جسم صلب يسمى الجليد إذا تم خفض درجة حرارة الماء إلى أقل من 0 درجة مئوية. أما في حال تم رفعها إلى 100 درجة مئوية أو أكثر، فإنه ينتقل إلى الحالة الغازية ليشكل البخار. يعتبر تحول المادة بين الحالات الثلاث تغيراً فيزيائياً وليس كيميائياً، وذلك لأن التركيب الكيميائي للمادة يبقى ثابتاً ولا يتغير. يتمثل هذا التغيير في فقد أو اكتساب المادة للطاقة حتى تتحول من حالة إلى أخرى، أو قد ينتج عن الضغط أو الحركة. فيما يلي العمليات التي قد تمر بها المادة أثناء تحولها بين الحالات الثلاث:
- الانصهار: (بالإنجليزية: Melting)، هي عملية انتقال المادة من الحالة الصلبة إلى السائلة، وذلك نتيجة اكتساب جزيئات المادة الصلبة بعضاً من الطاقة، لتبدأ بالتباعد عن بعضها البعض، والاهتزاز بشكل أسرع، وتبدأ المادة بالذوبان عندما تصل إلى درجة الانصهار (بالإنجليزية: Melting Point)، والتي تكون عند درجة حرارة مرتفعة وضغط معين.
- التجمّد: (بالإنجليزية: Freezing)، يعرّف على أنّه انتقال المادة من حالتها السائلة إلى الصلبة، وذلك عندما تبدأ المادة بفقد الحرارة، لتتباطأ عندها حركة جزيئات السائل، وتبدأ باتّخاذ مكان ثابت لها ضمن بنية المادة، وعندما يصل السائل إلى درجة التجمّد (بالإنجليزية: Freezing Point) عند درجة حرارة منخفضة وضغط معين، فإنّه ينتقل إلى الحالة الصلبة، ومن الجدير بالذكر أنّ معظم السوائل تتقلّص عندما تنتقل إلى حالتها الصلبة، ولكن يُستثنى من ذلك الماء الذي يتمدّد، وتتباعد جزيئاته عن بعضها البعض، وتقلّ كثافته عند تحوّله إلى جليد، وهذا هو السبب في طفوالجليدعلى سطح الماء.
- التبخّر: (بالإنجليزية: Vaporization)، هو عملية انتقال المادة من الحالة السائلة إلى الغازية عن طريق التبخير أو الغليان، فعند زيادة درجة حرارة السائل تبدأ مجموعة من فقاعات البخار بالتكوّن أسفل سطح المادة، حتى يصل لاحقاً إلى درجة الغليان، وذلك عند درجة حرارة عالية وضغظ معين، ليتحوّل بعدها إلى غاز.
- التكاثف: (بالإنجليزية: Condensation)، يعرّف التكاثف بأنّه عملية انتقال المادة من الحالة الغازية إلى السائلة، ويحدث عندما يفقد الغاز كمية كافية من درجات الحرارة، لتصبح الجزيئات أقرب، ومن الأمثلة عليه تحوّل البخار إلى ماء.
- التسامي: (بالإنجليزية: Sublimation)، هو عملية انتقال المادة من حالتها الصلبة إلى الحالة الغازية بشكل مباشر دون المرور بالحالة السائلة، وقد تمرّ المادة بهذا النوع من التحوّل عن طريق التبخير الفجائي (بالإنجليزية: flash vaporization) الذي يقوم على مبدأ زيادة درجة حرارة المادة بشكل سريع جداً يفوق درجة غليانها.
- الترسيب: (بالإنجليزية: Deposition)، هو عملية تحوّل المادة من الحالة الغازية إلى الحالة الصلبة بشكل مباشر، ودون المرور بالحالة السائلة، فعلى سبيل المثال يتحوّلبخارالماء إلى جليد أو صقيع عند ملامسة هواء ذي درجة حرارة أقلّ من المحيط لسطح صلب كأوراق النباتات، فيظهر الصقيع مباشرة على سطحها.